Le système suro-achiléo-plantaire constitue un continuum sur le plan anatomique et fonctionnel. D’un point de vue biomécanique, il permet la propulsion lors de la marche et joue le rôle d’amortisseur lors de la réception de saut. C’est dans ce type d’activité frénatrice que les contraintes mécaniques sont maximales (du fait de l’énergie cinétique mise en jeu), et que peut survenir une rupture partielle ou totale du tendon d’achille. Mieux que le modèle mécanique qui envisage le système suro-achiléo-plantaire comme un système propulseur-amortisseur, les données physio-pathologiques du travail concentrique-excentrique du muscle Triceps permettent de mieux appréhender la pathologie tendineuse chronique. Au cours de la marche, en particulier lors de la phase d’appui qui précède la propulsion, l’essentiel du travail musculaire du triceps s’effectue sur un mode excentrique. Lors de l’impulsion et de la réception du saut le Triceps travaille également sur le même mode. Les données récentes de la littérature impute au travail excentrique un fort potentiel pathogène à l’égard du tissu tendineux et musculaire au delà d’une certaine quantité de travail [8]. Le seuil de tolérance au travail excentrique est d’autant plus bas que le tissu tendino-musculaire n’est pas préparé à ce type de contrainte. Cette corrélation entre travail excentrique et tendinopathie explique que les sports de détente soient les plus fréquemment impliqués dans la pathologie tendineuse chronique qui fait le lit de la rupture tendineuse.
On considère habituellement la tendinopathie comme une pathologie multi-factorielle intégrant à la fois des facteurs intrinsèques et extrinsèques. Les facteurs extrinsèques, au premier rang desquels se trouve la charge de travail excentrique, sont prépondérants. On site également le chaussage inadéquate notamment par le fait d’une semelle trop rigide, le type de sol trop dur…, et autres facteurs susceptibles de solliciter de façon accrue les capacités d’amortissement du système suro-achiléo-plantaire. Certaines erreurs d’entraînement (déséquilibre dans la répartition des phases de travail et de récupération, étirements tendino-musculaires insuffisants, place démesurée accordée à la pliométrie…) peuvent également être en cause. En fait, tous ces facteurs sont, plus ou moins, impliqués directement ou indirectement dans la physio-pathologie du travail excentrique du triceps.
Les facteurs intrinsèques peuvent, quant à eux, jouer un rôle favorisant en augmentant les contraintes mécaniques ou en diminuant la résistance du tissu tendineux au travail excentrique. Ainsi les troubles morphostatiques du pied, tel le pied en hyperpronation qui affaiblit l’action du triceps, sont classiquement des facteurs invoqués. Par ailleurs, il est possible que les troubles morphostatiques de l’arrière pied soit de nature à modifier la transmission des lignes de force passant par le tendon d’achille avec des zones hypercontraintes et des zones hypocontraintes. Le déficit de flexion dorsale de la cheville par rétraction tendino-musculaire va inévitablement augmenter l’intensité des contraintes mécaniques sur le tendon lors de toute activité frénatrice du muscle triceps. Une insuffisance du muscle tricipital serait également, pour certains [10], un facteur favorisant surtout, là encore, lorsque le déficit apparaît sur le mode excentrique. D’autres facteurs intrinsèques à savoir, le vieillissement, certaines maladies métaboliques comme la goutte, les rhumatismes inflammatoires, les dyslipémie ou tout simplement une mauvaise hygiène de vie (alimentation hyperprotidique, hydratation insuffisante,…) vont agir, notamment, en altérant les propriétés et les capacités du tissu tendineux à résister aux contraintes mécaniques. C’est aussi le cas de certains médicaments, que l’on peut classer parmi les facteurs extrinsèques et qui peuvent favoriser la survenue de tendinopathies ou ruptures tendineuses. Nous faisons allusion ici aux antibiotiques de la classe des Quinolones qui ont un effet iatrogène maintenant bien documenté. Il en est de même des corticoïdes, par voie locale, largement mis en cause dans la survenue de rupture tendineuse lorsque l’injection est réalisée en intra-tendineux. Leur usage peut être licite, dans la gaine synoviale, comme traitement de certaines formes de téno-synovites. Le terme de tendinite est inapproprié [11] car il revêt un sens trop restrictif d’inflammation du tendon, et reflète donc mal le cadre nosologique de la tendinopathie d’achille. Celle-ci ne correspond pas à une inflammation proprement dite du tendon mais plutôt à un phénomène dégénératif. L’étude histologique [1] ne retrouve pas, en effet, de cellules inflammatoires mais une augmentation de glyco-aminoglycanes et des changements dans la structure des fibres de collagène et dans leur agencement. Il vaut donc mieux préférer le terme de tendinopathie à celui de tendinite.
La tendinopathie d’achille de sur-utilisation est habituellement une pathologie du sportif jeune dont le stade ultime est la rupture du tendon qui survient à un âge plus avancée. Blazina décrit 4 stades cliniques, même si la corrélation entre la gravité des lésions tissulaires et la clinique n’est pas très bonne puisque certaines tendinopathies d’achille chroniques peuvent évoluer de façon totalement asymptomatique. Néanmoins, il est commode de se référer aux stades de Blazina pour suivre l’évolution et pour la conduite du traitement. Le stade I correspond à une douleur de dérouillage qui survient au début de l’effort et disparaît avec l’échauffement. Au stade II la douleur apparaît au début de l’effort puis disparaît pour réapparaître au décours de l’effort. Le stade III se caractérise par une douleur permanente invalidante dans la pratique sportive et au quotidien. Le stade IV correspond à la rupture du tendon. Le traitement médical est d’autant plus efficace qu’il intervient précocement. Il doit s’accompagner d’un repos sportif, particulièrement prolongé au stade III.
Habituellement, et pour reprendre la classification de Rodineau, on distingue 3 types de tendinopahie : les tendinopathies d’insertion, les tendinopathies nodulaires en plein corps et les péritendinites ou ténosynovites qui correspondent à une inflammation de la gaine synoviale du tendon [5, 11]. Il est préférable de classer à part les bursites de l’arrière pied.
Le diagnostic d’une tendinopathie est clinique, avant tout, et repose sur le classique trépied associant douleur à la palpation, à l’étirement tendino-musculaire et lors de la contraction résistée.
Le Triceps étant un muscle puissant, la contraction résistée doit être testée en charge, de façon graduelle (élévation en demi-pointe en bipodal, marche en demi-pointe puis élévation en monopodal). Parfois seul le sautillement monopodal en demi-pointe permet de réveiller la douleur.
La recherche de la douleur à l’étirement du triceps sural doit être réalisée en charge, lorsque l’étirement manuel est indolore.
La flexion plantaire n’est pas douloureuse en cas de tendinopahie d’achille. Il faut examiner le pied sur podoscope afin de rechercher un trouble statique.
La radiographie à » rayon mou » et l’échographie permettent d’objectiver un épaississement des parties molles et constituent une aide à la conduite du traitement. L’IRM est à réserver à l’évaluation pré-chirurgicale des tendinopathies.
I – Les bursites
D’un point de vue anatomique, on distingue deux bourses séreuses pré-achiléenne, et rétro-achiléenne. Ces bourses séreuses peuvent s’enflammer, le plus souvent à la faveur d’un conflit mécanique. Lorsque se produit un conflit entre le tendon d’achille et le contrefort trop montant et trop dur de la chaussure, assez fréquemment chez la femme, il peut en résulter une inflammation de la bourse séreuse rétro-achilléenne. Sur le plan clinique cette bursite se traduit par une tuméfaction rétro-achiléenne douloureuse à la palpation. Le traitement nécessite la levée du conflit mécanique. La corticothérapie locale est à récuser en raison du risque septique. Le conflit mécanique peut également se produire entre le tendon d’achille et l’angle postéro-supérieur du calcanéum, entraînant ainsi une inflammation de la bourse séreuse pré-achiléenne. Ce conflit mécanique porte le nom de maladie de Haglund [9]. Le diagnostic peut être attesté par la radiographie osseuse qui objective un angle postéro-supérieur du calcanéum haut et proéminent. Cliniquement, il existe un empâtement des gouttières pré-achiléenne et une douleur à l’insertion. La radiographie peut objectiver une opacité du triangle de Kager situé en avant du tendon d’achille, et apparaissant hyperéchogène à l’échographie. Le traitement repose sur le port de talonnettes de façon à diminuer le conflit mécanique et sur l’utilisation d’anti-inflammatoires. En cas d’échec, il faut procéder à la résection chirurgicale de l’angle postéro-supérieur du Calcanéum. Plus rarement, la bursite peut survenir dans un contexte de rhumatisme inflammatoire (spondylarthropathie et polyarthrite rhumatoïde) de maladie métabolique (goutte). Habituellement le diagnostic étiologique ne se pose pas car la maladie rhumatismale est connue et la bursite apparaît comme une nouvelle localisation. La radiographie peut parfois mettre en évidence, dans ce contexte, une érosion postéro-supérieure du calcanéum.
II – La tendinopathie d’insertion
La symptomatologie se traduit par des douleurs siégeant au niveau de l’insertion du tendon d’achille. Il s’agit habituellement d’une tendinopathie de sur-utilisation. La palpation provoque une douleur élective sur la zone d’insertion. La radiographie standard peut parfois objectiver une ossification lamellaire sur la zone d’insertion du tendon (enthésophyte), ou une calcification intra tendineuse. Le traitement repose sur le repos sportif, les anti-inflammatoires et la prescription de talonnettes en matériau viscoélastique. Lorsque la talalgie est bilatérale et revêt un caractère inflammatoire, il faut rechercher une spondylarthropathie débutante. Il s’agit d’un rhumatisme inflammatoire touchant l’homme jeune, chez qui le phénotype HLA B27 est fréquemment rencontré. Les entésophytes calcanéens sont associés à d’autres localisations (sacro-iliaque, pubis, rachis…). La survenue d’une talalgie uni ou bilatérale chez l’enfant est le témoin d’une ostéodystrophie de croissance ou maladie de Sever. Il s’agit d’une souffrance du noyau d’ossification nécessitant un repos sportif suffisamment prolongé associé éventuellement à des talonnettes en matériau visco-élastique.
III – La tendinopathie nodulaires
Il s’agit habituemment d’une tendinopathie de sur-utilisation. Le nodule tendineux qui siège habituellement en plein corps tendineux est le témoin d’une micro-rupture dont la cicatrisation des fibres collagéniques s’est effectuée de manière anarchique. La symptomatologie se traduit par des douleurs mécaniques en plein corps tendineux, selon les stades de Blazina qui ont été décrit. L’évolution naturelle de cette tendinopathie chronique peut aller jusqu’à la rupture partielle ou complète qui survient vers la cinquantaine, le plus souvent à la faveur d’une contraction excentrique du triceps. L’examen clinique retrouve tous les signes positifs du trépied clinique de la tendinopathie, avec en outre l’existence d’un nodule tendineux siégeant habituellement au regard du tiers moyen du tendon. En présence de signes inflammatoires locaux chez le sujet de la cinquantaine, il faut évoquer une rupture partielle. La radiographie à » rayon mou » peut objectiver des calcifications intra-tendineuses. L’échographie osseuse voire l’IRM est utile surtout si l’on soupçonne une rupture partielle qui peut déboucher sur un traitement orthopédique ou chirurgical. Il est utile de réaliser un bilan biologique afin d’éliminer une maladie métabolique comme la goutte ou l’hypercholestérolémie essentielle qui peut se manifester dès l’adolescence par des tendinopathies achiléennes aiguës récidivantes avec xanthomes tendineux. Le traitement repose, bien entendu, sur la correction du trouble métabolique. Le traitement de la tendinopathie nodulaire de sur-utilisation est avant tout conservateur et repose sur le repos sportif, l’utilisation des AINS et les soins physiques pour lutter contre la douleur. Si l’arrêt sportif est impératif, la poursuite d’une activité musculaire infra-douloureuse, de faible intensité, est souhaitable. Ce traitement antalgique doit être complété par un des étirements tendino-musculaires, et par la réalisation d’un massage transverse profond ou, mieux, par l’application d’ondes de choc, à raison de 3 à 5 séances séparées de 5 à 7 jours. Les protocoles de renforcement excentrique selon Stanish jouent un rôle essentiel pour augmenter la résistance du tissu tendineux. Cette deuxième phase du traitement permettra d’assurer une guérison durable et de diminuer le recours au traitement chirurgical [1, 2]. Celui-ci consiste à réaliser des scarifications longitudinales ou peignage tendineux parfois associé à la résection d’un nodule tendineux. Cette intervention peut être réalisée à » ciel ouvert » ou par voie percutanée qui a l’avantage d’offrir des suites opératoires plus simples. Les résultats de la chirurgie sont bons ou très bons à court terme mais tendent à se détériorer à long terme [1]. Quoiqu’il en soit, le traitement chirurgical ne doit intervenir qu’après échec d’un traitement médical bien conduit et suffisamment prolongé d’au moins 3 à 6 mois [3, 12].
IV – Les péritendinites
Les péritendinites ou ténosynovites correspondent à une inflammation de la gaine du tendon. Elles peuvent revêtir un caractère exudatif, le plus souvent dans un contexte de rhumatisme inflammatoire ou métabolique, ou plus rarement encore dans un contexte de sepsis. Parfois, l’étiologie n’est pas retrouvée. Les ténosynovites peuvent aussi s’associer à un phénomène caractéristique de crépitement perceptible sous le doigt et audible au stéthoscope. On parle alors de ténosynovite crépitante. Cliniquement, le tendon est globalement épaissi et douloureux. Sa mise en tension réveille également la douleur. A la radiographie, rayon mou, il existe un épaississement des parties molles. L’échograhie objective un tendon globalement épaissi et permet de faire la différence entre ténosynovite avec exudat et ténosynovite » sèche « . Le traitement repose sur le repos sportif et la prescription d’anti-inflammatoires. L’infiltration péri-tendineuse est réservée au forme exudative ne répondant pas au traitement médical de première intention.
V – La rupture du tendon d’achille.
La rupture du tendon d’achille survient sur un tendon dégénératif, ce qui explique que, selon Houshian [6], l’âge moyen de la rupture est de 42 ans. En fait le pic d’incidence varie selon le niveau de contraintes auquel est exposé le tendon. Il se situe chez le sportif entre 30 et 49 ans et chez le sédentaire entre 50 et 59 ans. L’homme est 3 fois plus souvent concerné que la femme [7]. La rupture peut survenir à la faveur d’une violente contraction excentrique du triceps (réception d’un saut) ou à la faveur d’un mécanisme traumatique minime, traduisant l’importance de la dégénérescence tendineuse. Le sujet perçoit une douleur postérieure plus ou moins vive comme s’il avait reçu un coup sur le tendon, avec craquement audible. L’impotence fonctionnelle initiale diminue rapidement permettant au patient de marcher, avec boiterie, grâce à l’utilisation de compensations. L’interrogatoire permet parfois de retrouver des antécédents de tendinopathie chronique mais quelques fois il n’existe aucun antécédent de cet ordre. Il faut également rechercher des antécédents d’infiltration ou la prise de quinolones.
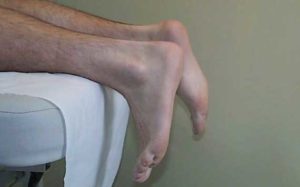
L’examen clinique retrouve une verticalisation du pied lors du décubitus ventral ou tout au moins une augmentation passive de la dorsi-flexion. La réponse à la manœuvre de Thompsen est négative ou asymétrique, c’est à dire que l’empoignement du triceps, chez un patient en décubitus dorsal, pied dans le vide, ne provoque pas de flexion plantaire du pied. La palpation soigneuse du tendon d’achille permet de retrouver une dépression, en regard de la zone de rupture. Mais celle-ci peut être remplacée par le gonflement lié à la constitution d’un hématome. L’élévation unipodale est impossible du coté lésé. En cas de rupture partielle, les signes cliniques sont moins formels et l’échographie permet de confirmer le doute diagnostic. Le traitement orthopédique a l’inconvénient d’exposer le sujet au risque de rupture itérative (15 à 20% en moyenne). Il nécessite 10 à 12 semaines d’immobilisation. Le traitement chirurgical offre davantage de sécurité vis à vis du risque de rupture itérative. Pour améliorer la solidité du geste chirurgical, il est possible d’utiliser un renfort synthétique ou au plantaire grêle. L’inconvénient principal de la chirurgie » à ciel ouvert » est le risque cutané et infectieux qui n’est pas négligeable. La technique de la ténorraphie per-cutanée semble prometteuse avec des suites plus simples, et en particulier avec des complications cutanées moins fréquentes [4]. Elle repose sur le rapprochement et la contention des 2 extrémités tendineuses par du fil dacron mis en place par voie transcutanée. Cette technique, est à réserver aux ruptures nettes en plein corps. Quelque soit le traitement choisi, le rôle de la rééducation est essentiel et conditionne, pour partie, la réussite du traitement. En conclusions… Le diagnostic de tendinopathie d’achille est d’abord un diagnostic clinique où l’imagerie standard (radiographie et échographie) a pour rôle d’aider dans la conduite du traitement. Il faut réserver l’IRM au bilan pré-opératoire des tendinopathies réfractaires au traitement conservateur. Si la tendinopathie d’achille est dans la grande majorité des cas une pathologie de surutilisation, il ne faut pas oublier qu’un certain nombre de talalgies postérieures échappent à ce cadre nosologique. C’est pourquoi il faudra systématiquement penser aux diagnostics différentiels en présence de toute tendinopathie revêtant un caractère atypique, en particulier s’il existe un contexte inflammatoire par l’horaire de la douleur ou la biologie. Les facteurs métaboliques seront également recherchés. La rupture d’achille repose sur un diagnostic clinique où l’imagerie n’a d’intérêt que dans le cadre des ruptures partielles. La chirurgie qui peut intervenir après échec du traitement conservateur de la tendinopathie ou après rupture tendineuse, devra toujours être suivie d’une rééducation bien conduite, suffisamment prolongée et surtout, d’un programme de prévention secondaire, basé sur la mise en œuvre d’un renforcement excentrique, afin de prévenir la survenue d’une rechute.
Bibliographie
1 – Alfredson H, Lorentzon R. Chronic Achilles tendinosis : recommendations for treatment and prevention. Sports Med. 2000, 29(2), 135-46 2 – Alfredson H, Pietilä T, Jonsson P, Lorentzon R. Heavy-load eccentric calf muscle training for the treatment of chronic achilles tendinosis. Am J Sports Med. 1998, 26 (3), 360-66 3 – Angermann P, Hovgaard D. Chronic Achilles tendinopathy in athletic individuals : results of nonsurgical treatment. Foot ankle Int 1999, 20 (5), 304-6 4 – Buisson P, Batisse J, Potier L, Fabre A, Guillemot E. Traitement des ruptures du tendon d’Achille selon la technique de ténorraphie percutanée. J. Traumatol . Sport 1996, 13, 204-11 5 – De Labareyre H. Tendinopathies d’achille. Lésions, options thérapeutiques, imageries. Médecins du sport 1997, 11, 28-30 6 – Houshian S, Tscherning T, Riegels-Nielsen P. The epidemiology of achilles tendon rupture in a Danish county. Injury, 29 (9), 651-654 7 – Leppilahti J, Puranen J, Orava S. Incidence of achilles tendon rupture. Acta Orthop Scand 1996, 67 (3), 277-2779 8 – Middleton P, Trouve P, Puig P. Les effets du travail musculaire excentrique. Act Rééd Fonct et Réad, Masson 1994, 19, 22-27 9 – Myerson MS. Disorders of the insertion of the achilles tendon and achilles tendinitis. J. Bone and Joint surg. 1998, 80-A (12), 1814-1824 10 – Nichols AW. Achilles tendinitis in running athletes. J Am Board Fam Pract 1989, 2(3), 196-203 11 – Sabourin F. Les atteintes du tendon d’achille. J. Traumatol. Sport 1994, 11, 65-69 12 – Watin-Augouard L, Kouvalchouk JF. Les aspects chirurgicaux des atteintes du tendon d’achille. J. Traumatol. Sport 1994, 11, 77-81 1
